藥品研發原始資料的規范要求及常見問題解析
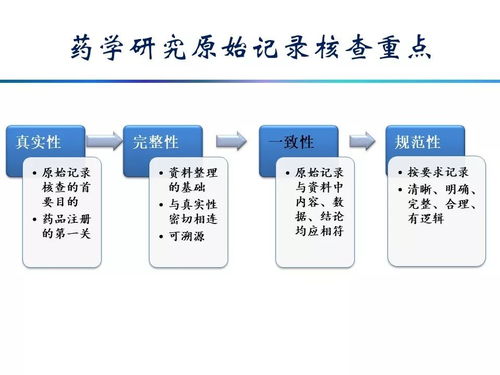
在藥品研發領域,原始資料的管理是確保研究質量和合規性的關鍵環節。原始資料包括實驗記錄、數據表格、分析報告及其他相關文檔,其規范要求關系到藥品注冊審批的順利進行。根據相關法規,如《藥品管理法》和《藥物非臨床研究質量管理規范》(GLP),原始資料必須真實、完整、可追溯,并采用統一的格式記錄,以保障數據的可靠性。實踐中常見的問題包括記錄不完整、數據缺失或涂改、簽名不規范等,這些都可能引發監管審查風險。例如,未及時記錄實驗過程可能導致數據可信度下降,影響后續申報。為應對這些問題,建議研發機構建立健全的標準操作規程(SOP),強化人員培訓,并利用數字化工具進行數據管理。隨著計算機軟硬件技術的飛速發展,藥品研發行業正逐步采用先進的系統來優化原始資料處理。計算機軟件開發能夠提供定制化的數據采集和分析平臺,例如電子實驗室筆記本(ELN)和實驗室信息管理系統(LIMS),這些系統自動記錄和存儲數據,減少人為錯誤,提高效率。硬件設備的更新,如高精度傳感器和自動化實驗儀器,增強了數據采集的準確性和一致性。在銷售環節,相關軟硬件產品需符合行業標準和安全規范,以確保數據完整性和用戶合規性。結合規范要求和數字化趨勢,藥品研發原始資料管理將邁向更高水平的自動化和智能化,助力行業創新與發展。
如若轉載,請注明出處:http://www.sinina.cn/product/6.html
更新時間:2026-01-07 14:40:25